當一個惡性腫瘤切除的手術在開刀房完成後,有另一群醫療人員,會在病理實驗室裡展開一連串的後續工作。他們將檢體切片、處理以做腫瘤的診斷及分期,在診斷的過程中,某些類型的癌症會另外採用免疫組織化學染色法,去觀察組織中一種叫「Ki-67蛋白」存在的多寡,進而去評估腫瘤的增生程度。倘若Ki-67的量很多代表腫瘤增生較快,腫瘤表現Ki-67較多的病人通常也有較不好的疾病病程及較差的存活率。
Ki-67檢測的方法已經行之多年,雖然Ki-67已確定與細胞增生有關,但是至於Ki-67蛋白是如何的參與腫瘤惡化的機制,卻不是十分明確。基因體研究中心蕭宏昇實驗室,選定非小細胞肺癌做為研究標的,歷經四年的抽絲剝繭,終於解開了這其中的來龍去脈,也領先全球證實了另一個細胞核內的NIFK蛋白如何抑制RUNX1,在此中扮演了關鍵的角色。該研究近日已發表在 eLIFE期刊。
這個研究始於中研院生化所蔡明道院士的指導與鼓勵。蔡院士早在2005年,就找到NIFK與Ki-67密切依存的分子機制,為NIFK的重要性提供了線索。為了進一步的探討,蕭老師實驗室展開一系列的步驟。
 |
| 研究團隊(由左到右):林琮傑博士、蔡明道院士、蕭宏昇研究員、研究助理蘇佳沂。 |
首先,使用全球公開的醫療大數據資料庫,他們從多種的癌症病理資料裡,經過分析,在十幾種癌症,數千個病例中,都找到Ki-67與NIFK並存的蹤跡,其中,以肺癌、大腸癌、乳癌最明顯,且以肺癌為相關性最高的。同樣由大數據的分析,他們也發現,在各種癌症中,NIFK在肺癌有最強的存活率預測能力,NIFK表現量高的肺癌患者,可預測其有較差的存活率。
此外,於蕭老師實驗室,從取自台灣各類癌症的病人的組織矩陣中分析,也發現取自同一肺癌病患的檢體中,相較於正常肺組織,肺癌組織有較強的NIFK表現。因此,NIFK明顯成為肺癌治療研究的一個關鍵目標。接下來,再以肺癌患者的臨床資料來分析,同樣可觀察到NIFK預測存活率的能力,且NIFK值高的患者,也較常見癌細胞轉移到淋巴組織或遠端器官的現象。因此,研究人員更加確定,NIFK在肺癌轉移的機制,應該有很重要的角色。
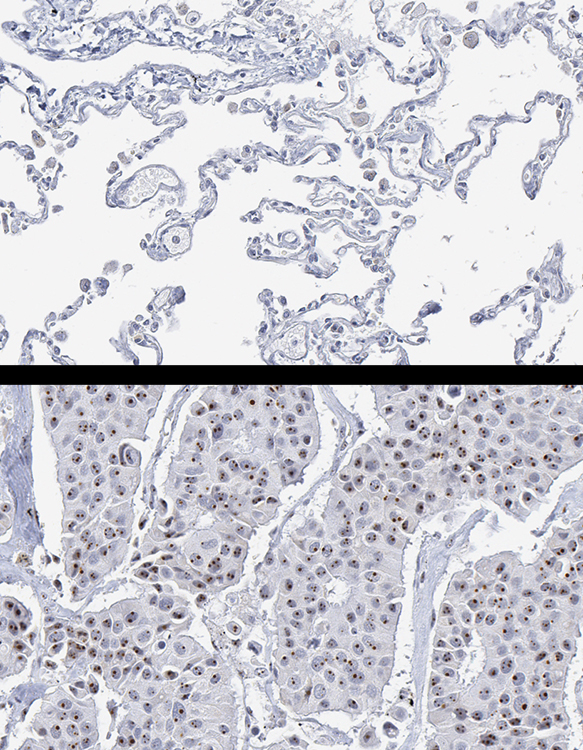 |
| 上圖為人體正常肺部組織切片的NIFK免疫組織化學染色,正常肺泡細胞形狀扁平且規則,nucleus細胞核仁內無NIFK免疫組織化學呈色。下圖為肺癌組織切片的NIFK免疫組織化學染色,癌細胞核仁內可見許多深棕色的小點即為NIFK免疫組織化學呈色。下圖肺癌組織明顯的NIFK表現,對比於上圖正常肺部組織無NIFK表現,顯示NIFK免疫組織化學染色為病理檢測上具體可行的方法。 |
進一步以肺癌細胞株的研究中,團隊將NIFK過度表現之後,發現癌細胞轉移能力增加,如果抑制NIFK的表現,癌細胞轉移能力也就相對受到控制。小鼠動物實驗中,肺癌細胞的轉移現象也與NIFK的多寡有直接的關聯性。研究人員下一步要尋找的是,Ki-67是否參與NIFK所調控的肺癌惡化機制?
研究發現,原來NIFK與Ki-67的蛋白結合是一個讓肺癌細胞增生的關鍵,然而,前述NIFK調控肺癌細胞轉移的功能上,卻與Ki-67不相關。過去研究已知,細胞內的CK1分子,是天然的腫瘤惡化煞車手,可以防止細胞不斷的增生與轉移,團隊發現,原來,NIFK會抑制一個RUNX1分子的表現,而 RUNX1就是生成CK1的一個轉錄因子。這個RUNX1的轉錄調控機制,在暨有的科學文獻中是第一個被提出來。
這個研究的結果讓團隊十分振奮,本身就是病理醫師的共同第一作者蘇佳沂表示:『如果能夠在病理檢查時,就直接研判NIFK的多寡,可用以篩選出預後較差且帶有較具轉移性質的腫瘤的肺癌病人,而採取積極的治療。』。至於接下來要如何的針對NIFK尋找對策,第一作者博士後研究員林琮傑表示,他們將面臨更多的挑戰,NIFK是如何出現的?是否已經有抑制NIFK的方法了?NIFK除了在非小細胞肺癌的轉移獨挑大樑,還在別種癌症上有相同的影響嗎?基礎研究的路雖漫長,可以帶給人類福祉的努力卻不會間斷!
這個研究集結了多方的研發心血,包括基因體研究中心蕭宏昇老師的研究團隊、生化所蔡明道老師的研究團隊,高雄醫學大學黃明賢醫師、楊志仁醫師和劉于鵬老師,高雄榮總葛魯蘋老師、張宏泰醫師,台北醫學大學林源峰老師、陳志榮醫師,雙和醫院葉淇臺博士,與加州大學聖地牙哥分校Dr. John Shyy。這個研究在中研院主題計劃、登峰計劃,以及科技部的經費支持下得以完成。

