 中研院基因體研究中心在禽流感的相關研究,最近在美國國家科學院期刊(Proceedings of the National Academy of Sciences of the United States of America, PNAS) 發表令人振奮的結果。研究團隊針對導致禽流感的H5N1病毒研發出基因型疫苗,並證明用在小鼠身上對多種不同類型的禽流感病毒有極佳的保護力。這個研究可望日後發展成可預防多種流感病毒的疫苗,也替禽流感可能造成人類致命性威脅的隱憂提供了一個定心丸。
中研院基因體研究中心在禽流感的相關研究,最近在美國國家科學院期刊(Proceedings of the National Academy of Sciences of the United States of America, PNAS) 發表令人振奮的結果。研究團隊針對導致禽流感的H5N1病毒研發出基因型疫苗,並證明用在小鼠身上對多種不同類型的禽流感病毒有極佳的保護力。這個研究可望日後發展成可預防多種流感病毒的疫苗,也替禽流感可能造成人類致命性威脅的隱憂提供了一個定心丸。
這個研究由翁啟惠院長與何大一院士共同主持,並在陳鈴津特聘研究員及鄭婷仁研究助技師的合作下完成。
『凝血素』即 Hemagglutinin,簡稱為 HA,為禽流感病毒的外膜上的一種蛋白分子,是引發免疫反應的關鍵之一。不同的流感就是以其HA 的差異所分辨的,例如H1, H3 為二種主要人類流感病毒上的 HA 蛋白。H5N1之所以可怕就在於H5可能突變成可感染人類的病毒。因此,研究團隊在分析這些來自全球各地禽流感病毒株的HA序列後,由這些HA序列片段的異中求同,設計出一個共同的關鍵性的新HA序列片段,命名為『Consensus HA』。
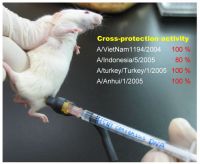
然後,運用基因工程的技術製造這樣的基因片段,再將這個病毒基因注射到小鼠體內。實驗結果顯示,這些小鼠不但體內會產生對禽流感病毒的抗體,也產生了細胞免疫反應。接著,在三級安全生物實驗室內,注射過該疫苗的小鼠分別暴露於代表性的越南株、印尼株、土耳其株及安徽株等四種禽流感病毒之下。結果,只有百分之二十的小鼠會因感染印尼型的H5N1病毒發病;其他三種病毒株的威脅均降至零。
相關研究人員均表示,此結果令人振奮,或許可能成為將來發生禽流感時的預防對策。日後,就算病毒產生突變,這個方法也可以快速的改變基因序列,再設計製成疫苗,以防範不同類型的病毒株。
該論文的第一作者陳名偉是主要的實驗操作者,目前仍為陽明大學的研究生,他表示,基因疫苗比較容易製造,也較傳統用減低毒性的病毒或死掉的病毒所製造的疫苗風險低。然而,科學醫藥界其實在『基因疫苗的研發』上多出現瓶頸,主要原因為基因疫苗並無法非常有效地進入動物體內。何大一院士多年來專注在愛滋病毒基因疫苗的研究,為了突破這個基因疫苗的問題,使用了動物體內電穿孔(electroporation)的技術。研究人員引用這個方法,在施打疫苗同時加上電流。就這麼一擊,產生大不同的效果,顯著提升了基因片段進入細胞內部的量,帶有『Consensus HA』的細胞可被血液中的免疫系統辨識,免疫的反應就出現了。
基因體中心的這個研究,自2006年得到『衛生署疾病管制局』(CDC)的研究經費的支持下而展開。目前,這個疫苗已由『生物技術中心』(DCB)進行量產及動物安全試驗,預計年底完成並申請新藥試驗的許可,以便將來可進行人體試驗。該計畫的『疾病管制局』相關負責人,血清疫苗中心劉定萍主任表示,『非常高興中研院的團隊在從事基礎研究之外,願意投入疫苗研發來解決國家重要的防疫議題;尤其能在計畫進入第三年之際,即有重大成果發表,實屬不易。』
該篇 PNAS 論文 『A consensus-hemagglutinin-based DNA vaccine that protects mice against divergent H5N1 influenza viruses』已於PNAS網站刊登並得到期刊編輯群的重視,特別於其『當週重點研究報導專欄』內作摘要報導。


