O-GlcNAc,或稱「O 連結乙醯葡萄氨糖」,是一個逐漸開始被注意的細胞內的單醣分子。 之前蛋白質「磷酸化」被認為是主要負責細胞內訊息傳遞的功臣,而O-GlcNAc修飾蛋白質的現象被發現更進一步調節訊息傳遞路徑。
本中心林國儀老師致力於免疫機制的研究,其團隊與化學所陳玉如老師合作,利用質譜儀追蹤不同條件下B細胞活化後細胞內的「磷酸化」蛋白,結果發現LSP1蛋白可能是決定B細胞活化後生死存活的樞紐,而磷酸化與O-GlcNAc醣化在LSP1蛋白透過先後時間順序接棒式的交互作用,啟動了B細胞活化後生死存活的開關。 這個研究是第一個解構在免疫細胞活化時,O-GlcNAc「醣化」及「磷酸化」的動態交互作用,並證明具有重要的功能,近期已在Nature Communications 期刊發表。
在人體的免疫系統裡面,B細胞扮演很重要的角色,它可以在偵測到體內有外來入侵物時開始活化;目標是打造抗體,終極目的為消滅並且防止入侵物的擴散與壯大。當B細胞經由B細胞接受器(B cell receptor)展開活化的機制時,若是活化的力道不夠,最後可能無法產生質與量均佳的抗體,在防禦上出現漏洞;反之,若是活化過度,則可能會導致自體免疫疾病。所以在 B細胞活化的過程中,必須啟動一連串精細的調控策略,之前研究僅了解這需要蛋白質的磷酸化來促成B細胞活化複雜的訊息網路傳遞。
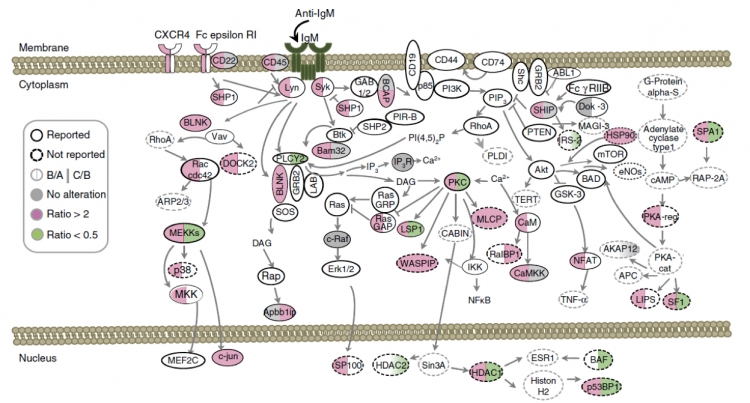
圖2:細胞活化後,內部綿密的訊息傳遞開始展開,大量的醣化和磷酸化作用參與其中
哺乳類細胞中,蛋白質的磷酸化大多是發生在「絲氨酸」(Serine)及「蘇氨酸」(Threonine)這兩種氨基酸上。巧合的是,O-GlcNAc的醣化作用,也發生在「絲氨酸」和「蘇氨酸」上,因此,這兩種修飾可能發生在同一個氨基酸。然而,O-GlcNAc的醣化與磷酸化之間的關係是競爭還是互補,之前沒有定論。
研究團隊決定先以蛋白質體學分析B細胞活化過程中不同階段的變化,因此,開始與在磷酸化的質譜分析素有專精的陳玉如老師實驗室的合作。根據本論文的第一作者吳忠霖博士的敘述,他們從小鼠脾臟檢體內分離出B細胞並加以活化,再由陳老師實驗室吳欣怡博士著手進行質譜分析,可以鑑定出超過三千個磷酸化的「絲氨酸」和「蘇氨酸」。為了要更進一步釐清O-GlcNAc醣化和磷酸化之間的交互作用,團隊在B細胞活化過程前加入移除O-GlcNAc醣化作用的抑制劑,再來檢測磷酸化的變化。在224個受到影響的磷酸化蛋白質中,他們發現位於B細胞活化路徑中的Lsp1之磷酸化會受 O-GlcNAc醣化的影響。
研究團隊進一步揭露了在B細胞活化開始的階段,Lsp1絲氨酸209的位置就會被標記O-GlcNAc醣化。再由一連串的分子生物學實驗發現,在接上了這個O-GlcNAc單醣後,Lsp1蛋白會和PKC這個酵素結合,PKC再進而對Lsp1蛋白絲胺酸243進行後續磷酸化。所以, O-GlcNAc醣化是磷酸化Lsp1的引導者。更進一步研究發現,絲胺酸243的磷酸化,導致B細胞活化後走向凋亡。因此,發生在絲胺酸209醣化作用的前置作業,可以說是掌控了B細胞活化後,走向存活或凋亡命運的關鍵。
這個研究的結論指出,對於B細胞而言,O-GlcNAc醣化作用的發生決定了B細胞活化後的生死。而在自體免疫疾病中,存在著許多過度反應,卻沒有及時被移除的B細胞。因此,這個發現開啟了B細胞活化的另一個研究方向,如果能找出一個讓O-GlcNAc醣化適時適量作用的途徑,或許,這可成為治療的另一道曙光!
本研究的論文「Temporal regulation of Lsp1 O-GlcNAcylation and phosphorylation during apoptosis of activated B cells」可以在Nature Communications期刊網頁查詢。


