自從第一個愛滋病病例在1981年被診斷出來後,根據聯合國愛滋病規劃署的統計數字顯示,已經有超過3500萬人死於愛滋病,2016年全球的帶原者高達3670萬人,至今,全球每年仍約有250萬人死於愛滋病。然而,目前的各種療法,仍無法根除此一疾病。科學家咸認為,如果可以成功的開發出愛滋病疫苗,才可能治本。過去全球 有超過10多種愛滋病毒疫苗的研發,但在臨床實驗過程中,都相繼失敗。
近幾年科學家在感染愛滋病毒病患的身上,分離出一群被稱為「具廣泛性可中和各種愛滋病毒能力」的抗體 (即Broadly Neutralizing Antibodies,簡稱bNAbs)。bNAbs的發現讓愛滋病疫苗的開發工作出現一道新曙光,科學家們相信,只要能正確的解析出這些bNAbs的分子結構,就能利用這個分子結構當成抗原來設計出有效的疫苗。
研究又發現,有很大一部分的bNAbs是與愛滋病毒表面稱為gp120醣蛋白上的醣分子結合。gp120是一個高度醣化的醣蛋白,其總含醣分子量占這個分子總量的一半以上;而且,gp120上面醣分子的結構相當複雜,甚至有不少的bNAbs需要同時有兩種不同的醣分子一起協同作用,方能和病毒產生有效的結合。因此,解構這些bNAbs真正結合醣分子的工作,就變得棘手。
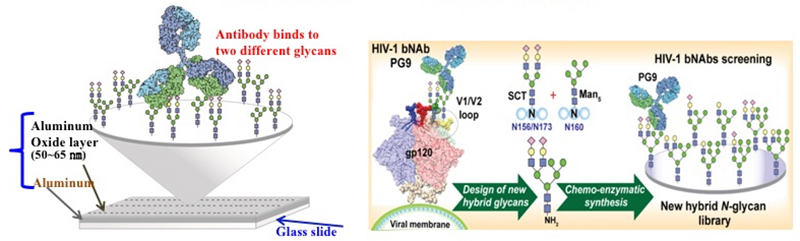
本中心翁啟惠特聘研究員及吳宗益研究員組成的研究團隊,兩年前成功開發出模組化N型多醣合成技術,這個技術可以快速的合成出gp120上的各種多醣結構。再配合團隊新開發出來的鍍鋁醣晶片,可以有效的篩選出可以和bNAbs結合的醣分子,特別是那些需要同時有兩種不同醣分子協同結合的bNAbs。
在先前的研究中,他們已經解析出兩種N型醣分子的協同,可以有效且大幅的提升其與此類bNAbs的結合力。這次的研究,研究團隊巧妙地將這兩種N型醣分子的主要鍵結部分結合,再藉由先前開發出的模組化合成法,合成出一系列「混合型的單一醣分子結構」。
|
| 圖一: (a) 藉由鍍鋁醣晶片高密度及高均勻性的特性,可在同一個點上種上兩種不同醣分子,用以快速篩選能對bNAbs產生協同結合效果的醣分子結構。(b) 藉由先前開發出的模組化N-型多醣合成策略可將篩選出的兩種醣分子組裝成一個混合型醣分子。 |
接著,研究團隊與美國Scripps研究機構的Dennis R. Burton教授及美國國家衛生院的Peter D. Kwong教授合作,合作團隊提供超過十數種具有較佳效果的bNAbs,然後,研究同仁利用此一系列混合型的單一醣分子,將之一一種在鍍鋁晶片,再用這種醣晶片,進行與bNAbs結合力的測試。
|
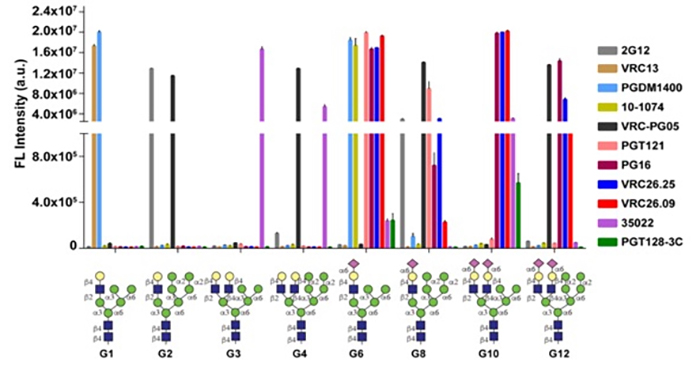
| 圖二: 各種混合型醣分子與不同bNAbs的結合力結果,G6及G10對多種bNAb都有強的結合力。 |
結果顯示,G6及G10兩種混合型醣分子,能夠與大多數的bNAbs產生很強的結合能力,特別是G10這個醣分子結構,其與其中一個名為PG9的bNAbs之間的結合力,較PG9與愛滋病毒gp120的結合力來得更強。
研究人員推測,這些不尋常的混合型醣分子,可能是愛滋病毒在生合成gp120時的醣化過程中所產生,進而引起免疫系統反應,讓人體產生抗體。所以,這些混合型的醣分子,極有潛力用來設計醣分子愛滋病疫苗的抗原。本論文的第一作者Vidya S. Shivatare博士及Sachin S. Shivatare博士表示,目前研究團隊正利用G6及G10兩種醣分子結構從事愛滋病疫苗的開發工作。
這個研究結果最近發表在《美國化學學會期刊》(Journal of the American Chemical Society)。本研究論文全文可於線上閱讀:https://pubs.acs.org/doi/pdf/10.1021/jacs.8b00896