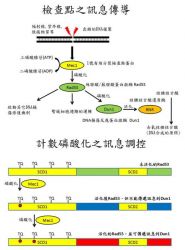
基因突變的累積與癌症的發生已被證實為因與果關係,而基因突變的發生主要是DNA損傷後未能及時修復所造成的。出錯的DNA複製以及日常生活中生物體DNA對於紫外光、輻射線、毒素或一些致癌物質等的威脅,都會造成基因的突變。因此為了維護DNA複製準確度與彌補外在因素對於基因組所造成的DNA損傷,真核生物體細胞已經演化出細胞週期檢查點(cell cycle checkpoint)之機制來調控整體基因組的穩定,以防止基因的突變。因此瞭解細胞週期檢查點(cell cycle checkpoint)之調控機制已成為了解癌症發生不可或缺的重要課題。
最近由本中心暨生物化學研究所蔡明道特聘研究員所領導的研究群在細胞週期檢查點(cell cycle checkpoint)的調控上有了重大突破的研究成果,該研究報告已經獲得美國「分子細胞」(Molecular Cell)期刊的青睞並於6月20日以"Featured Article" 刊登此重要研究結果。該研究報告結合了生化學、結構學、遺傳學與質譜學等研究方法,發現新的「計數磷酸化」(phospho-counting)的機制對於DNA損傷時訊息傳遞有非常重要的調控。
|
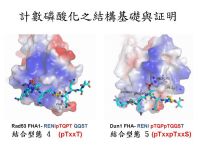
「絲胺酸/蘇胺酸蛋白激酶Rad53」(Serine/Threonine protein kinase, Rad53)是啤酒酵母菌(Saccharomyces Cerevisiae)細胞週期檢查點(cell cycle checkpoint)中負責傳遞DNA損傷訊息的重要蛋白質分子。在Rad53蛋白激酶的胺基酸序列上含有高達16個SQ/TQ的胺基酸序列,其中有兩群SQ/TQ集中在一起,為SCD1與SCD2(SQ/TQ cluster domain 1 and 2)。先前的研究也已經證實Mec1蛋白激酶會藉由磷酸化Rad53上SQ/TQ的胺基酸序列將傳遞訊息到下游,而且亦有研究指出Mec1可以藉由Rad53-SCD1的磷酸化修飾以調控Rad53蛋白激酶本身的酵素活性以及向將訊息傳遞到下游的「DNA損傷反應蛋白激酶 Dun1」(DNA damage response protein kinase, Dun1)。然而,卻不是很清楚在Rad53-SCD1上這一群連續四個TQ所蘊含的意義為何?蔡明道特聘研究員所領導的研究群結合了生化學、結構學、質譜學以及遺傳學等研究方法,發現並證實了Rad53-SCD1的磷酸化修飾存在著「計數磷酸化」(phospho-counting)的調控方式。
|
這個研究成果揭開並證實磷酸化如何調控DNA損傷訊息傳導的多重面向,橫向(Rad53-SCD1 與Rad53)與縱向(Rad53-SCD1與下游的Dun1)訊息傳遞可以由Rad53-SCD1磷酸化計數(phospho-counting)的模式來調控,此全新的DNA損傷訊息調控機制同時亦為癌症發生的基礎研究帶來嶄新的一頁。
此研究工作經費的乃是由國家衛生研究院的計畫and GRC所支持,本篇論文第一作者是蔡明道特聘研究員實驗室內來自南韓的李賢博士,而共同作者群中也包括台灣大學生化科學研究所博士班研究生陳聖文。本研究工作亦由澳大利亞Melbourne大學的Jorg Heierhorst博士所共同合作。論文標題與所貢獻之作者群如下:
“Di-phosphothreonine-specific interaction between SQ/TQ cluster and an FHA domain in the Rad53-Dun1 kinase cascade”. Hyun Lee, Chunhua Yuan, Andrew Hammet, Anjali Mahajan, Eric S.-W. Chen, Ming-Ru Wu, Mei-I Su, Jörg Heierhorst, Ming-Daw Tsai, Mol. Cell, Volume 30 Issue 6 June 20, 2008.