肝癌(HCC)是常見的癌症,高踞台灣前十大癌症排行。磁振造影(MRI)是目前診斷初期肝癌的最佳利器,但是因為肝組織與肝腫瘤成像對比難以區分會造成解讀上的困難,所以,為了提高圖像的強度對比,在顯影劑中要加入氧化鐵或是鐵鉑粒子等對比劑,才可以幫助醫療人員在用MRI追蹤肝癌時可以更容易。
本中心蕭宏昇老師實驗室與台大化學系劉如熹教授、北科大魏大華教授合作,篩選出最適合做為基底材料的高嶺土材料,利用高嶺土所提供的吸附作用,將具有超順磁性的鐵鉑奈米粒子(FePt NPs)夾在兩片高嶺土中,形成三明治結構的鐵鉑奈米複合粒子,不僅可以提高MRI對肝臟成像的靈敏度,也可以利用外加磁場,讓鐵鉑奈米粒子吸收磁力震動升溫,藉高溫燒灼周圍腫瘤組織,殺死癌細胞,甚至藉由高嶺土的高吸附力,可以同時攜帶化療藥物到達癌細胞所處之處,除了燒灼癌細胞之外,再釋放化療藥物,兩種治療相成,達到更強大的治療效果。
論文第一作者詹明賢博士表示,現今市面上多數的顯影劑,常使用氧化鐵顆粒或鍶離子複合物當作磁性震動載體,多會引起噁心、過敏反應或腎臟損傷等副作用。為了改善這些副作用,研究團隊的目標就是開發出降低顯影劑毒性,同時能夠提高MRI的分辨率,並且兼具治療效果的磁性載體。
新型鐵鉑奈米粒子可在T2加權的MRI磁場中,檢測暗場變化來標定癌細胞的位置,是顯影劑的熱門候選材料。為了尋找合適的載體,詹明賢博士遍尋多種材料並經由多方面的嘗試,最終選用高嶺土來吸附FePt NPs。高嶺土細顆粒具有穩定化學結構,並且具備均勻分布的孔洞結構與高吸附能力等特點。魏大華教授表示以一片片相疊的高嶺土將鐵鉑奈米粒子固定於夾層中,形成三明治結構的複合奈米材料,稱之為FePt@Kao。研究團隊使用一鍋化學還原法製備FePt@Kao奈米複合材料,不僅程序簡單而且成本較低。相較市面上常見的氧化鐵顯影劑,FePt@Kao具有低毒性、生物相容性高,以及成本較低的優勢。
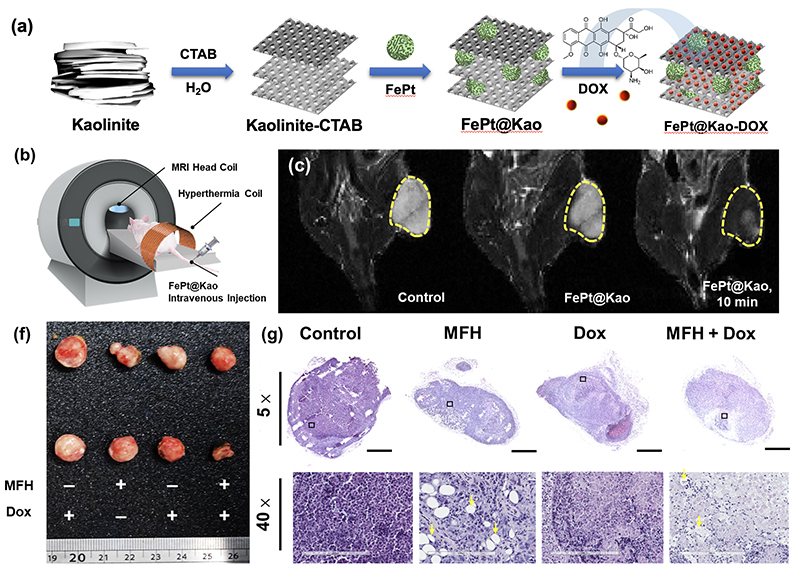 |
| (a) FePt@Kao-DOX奈米材料之製備,其合成化學過程如示意圖所示。(b) 模擬MRI成像過程與施用靜脈注射方式施打藥物。(c) 注射濃度為10 mg/mL之FePt@Kao後,對小鼠進行體內T2加權MRI成像。(d) 收集腫瘤組織並進行 (g) H&E染色,以5倍之視覺放大倍數獲取完整腫瘤圖像,並以40倍之腫瘤倍率分辨治療後組織變化。 |
從實驗數據顯示,FePt@Kao鐵鉑奈米粒子高度集中在特定的區域中,會較容易受到外加磁力的影響,即便施予較小的磁力,也能快速統一磁矩方向。這可以獲得兩種優勢,一個是在MRI的檢測中可以得到較強的訊號、得到明暗對比較為強烈的圖像,讓檢測人員明確的分辨出正常組織或是腫瘤組織,追蹤出更小的癌細胞存在。另一項優勢則是整齊排列的磁性粒子產生較均勻的磁力,可以產生較好的熱磁效應。若施以外加磁力的時候,可以引導具有磁性鐵鉑奈米粒子前往腫瘤組織,以MRI確認位置之後,加強磁場的強度,讓FePt@Kao吸收磁力產生震動,震動可以產生熱能。詹博士表示,加入高嶺土的FePt@Kao奈米粒子,因為吸附較大量的鐵鉑奈米粒子,所產生的磁場相較於單單僅是鐵鉑奈米粒子高出了78%。
以20 mg高嶺土的FePt@Kao樣品為例,在1.5分鐘可以達到42.5℃,超過足以殺死癌細胞的41℃。磁熱療法主要是利用高溫將無法承受溫度變化的病變細胞殺死,癌細胞就是一個典型的例子。運用外加磁場產熱方式,使局部被FePt@Kao標定的細胞升溫,抑制腫瘤組織增生,進而造成細胞凋亡,達到治療的目的。
除了吸附鐵鉑粒子之外,FePt@Kao更可以吸附化療藥物。Dox(Doxorubicin, 阿黴素)是一種普遍使用的化療藥物,單純使用化療藥物進到人體會被血液稀釋或被免疫系統所干擾,同時必須顧慮藥物所具有的毒性,會對人體產生副作用,譬如Dox就容易會對心臟產生累積性的傷害。FePt@Kao吸附的鐵鉑奈米粒子具有引導藥物的作用,利用外來的磁場將奈米磁性粒子導引到固定目標的位置進行治療,不但可以減少藥物流經體內循環產生嚴重的副作用,還可以減少藥物的浪費,是一個非常有效率的治療方法。
 |
詹明賢博士表示,他們的實驗結果顯示,FePt@Kao奈米複合材料可以大量吸收約60%的Dox。經由表面活化劑加以改良的FePt@Kao,具備更多層狀結構,可以更完好的保持化療藥物於奈米複合材料中,減少Dox在運送過程提早釋放,造成人體的副作用。劉如熹教授指出結合化療藥物更提供此平台雞尾酒式之治療方法,為人類醫學進步提供巨大貢獻。
未來對於癌症病人的治療照護將走向精準醫療,針對每個人不同的身體狀況以及病症,採取多種不同療法的搭配組合。研究團隊表示,為了因應此一趨勢,當初實驗設計的目的,就是建立出一個兼具診斷和治療的多功能的奈米材料平台。根據功能上的需求,以不同的高嶺土比例,可以製備出具有不同磁性以及吸附性的奈米粒子。FePt@Kao優化了磁性能以及吸附性能,同時了具備標定、影像、磁熱療法與載藥功能,每一個功能可以獨立運作,也可以兩三種搭配使用,應用在未來的精準醫療上,潛力無窮。
本研究結果發表於Chemistry of Materials(Chem. Mater. 2020, 32, 697-708),https://pubs.acs.org/doi/10.1021/acs.chemmater.9b03552。


